Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期傻傻分不清?一张图看懂临床试验全流程
临床试验作为药物研发体系中的核心环节,其根本目标在于系统评估新药在人体中的安全性、有效性及总体风险-获益特征。根据研究目标、样本特征及方法学设计的不同,临床试验被划分为Ⅰ至Ⅳ期,各阶段在科学问题和监管决策中承担不同职能。当前,研究者及公众对各阶段研究的设计逻辑与证据递进关系仍存在理解差异。为此,本文旨在通过清晰的阶段梳理和可视化图表,系统解析从早期剂量探索到上市后监测的全流程科学路径与决策逻辑。
一、临床试验的基本框架与图解
临床试验分为 Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期 四个阶段,每阶段目标明确、受试人群和样本量逐步扩大,最终形成完整的药物风险评估体系。此外,0期试验(微剂量研究)和仿制药生物等效性试验(BE) 作为补充环节,也值得关注。详细流程见图1。
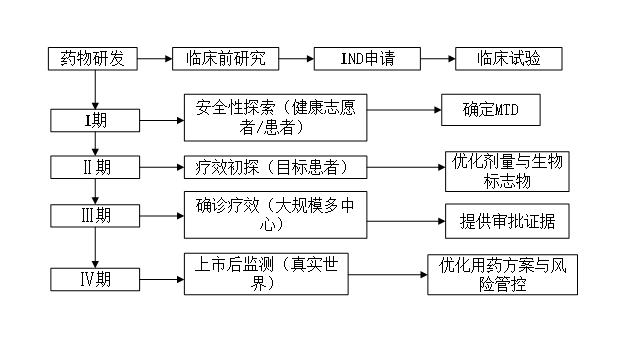
图1:临床试验流程图
二、各期临床试验详解
(一)Ⅰ期临床试验:安全性探索与剂量确定
Ⅰ期临床试验旨在评估药物的人体安全性与耐受性,确定最大耐受剂量(MTD),并初步探索药代动力学(PK)及药效动力学(PD)特征。试验通常在20–100例健康志愿者或特定患者中进行,包括单次剂量递增(Ia期)和多次剂量递增(Ib期)研究,逐步确立安全给药范围。同时监测药物的吸收、分布、代谢和排泄(ADME)过程,并初步观察生物活性指标。试验周期通常为数月至一年。例如,某抗癌药物从5mg起始剂量逐步递增,最终确定MTD为80mg,药物半衰期为6小时。
(二)Ⅱ期临床试验:疗效信号识别与方案优化
Ⅱ期临床试验旨在初步评估药物对目标适应症患者的治疗作用,并优化给药方案。试验纳入100–300例患者,核心任务包括验证生物标志物与临床终点的关联性,探索不同亚组人群(如年龄、性别、基因型)的疗效差异,并确定Ⅲ期推荐剂量(RP2D)。Ⅱa期进行概念验证(POC),确认药物疗效潜力;Ⅱb期开展剂量扩展研究,以明确最佳剂量及给药频率。试验通常持续2至3年。例如,某降压药Ⅱ期结果显示,60%患者血压达标,但女性耐受性较低,提示需针对性调整剂量。
(三)Ⅲ期临床试验:确证性疗效与风险获益评估
Ⅲ期临床试验旨在通过大规模、多中心研究确证药物的疗效与安全性,为监管审批提供关键证据。试验纳入300至3000例以上目标适应症患者,通常采用随机、双盲、对照设计,以验证其相对于标准治疗的优效性或非劣效性。核心任务包括建立完整的安全性数据库,识别发生率不低于1%的不良事件,并生成满足监管机构要求的确证性数据。试验一般持续3至5年。例如,某新冠疫苗Ⅲ期试验纳入10000例受试者,证实有效性达90%,且严重不良反应发生率低于安慰剂组。
(四)Ⅳ期临床试验:真实世界风险管控与适应症扩展
Ⅳ期临床试验在药物上市后开展,旨在通过真实世界广泛人群进一步监测其长期安全性与有效性,并探索新适应症应用。试验通常纳入超过10,000例受试者,包括孕妇、儿童等特殊人群,重点监测罕见不良反应(如百万分之一级别事件),评估药物经济学价值,并优化用药指南及联合治疗方案。研究可持续数年至数十年。例如,某抗抑郁药因上市后发现对青少年存在潜在风险,经Ⅳ期试验后更新了用药警告。
三、结语
从实验室到临床,从理论到实践,每一步严谨的探索都承载着对生命的敬畏与对健康的追求。临床试验的层层推进,不仅是科学方法的精准应用,更是医学进步的坚实阶梯。理解其内在逻辑,有助于公众更理性地看待新药研发,也为科研工作者提供了清晰的行动指南。在科学与伦理的双重护航下,这一流程将持续为人类健康事业注入动力,点亮更多希望之光。


